Кислород Из Кг Перевести В М3 В
Введение Кислород является самым распространенным элементом на земле, встречающимся в виде химических соединений в различными веществами: в земле – до 50% по массе; в соединении с водородом в воде – около 86% по массе и в воздухе – до 21% по объему и 23% по массе. При нормальных условиях (температура 20 °С, давление 0,1 МПа) – это бесцветный, прозрачный, негорючий газ, немного тяжелее воздуха, не имеющий запаха, но активно поддерживающий горение. При нормальных условиях масса 1 м 3 кислорода равна 1,33 кг. Кислород обладает высокой химической активностью и способен образовывать химические соединения (оксиды) со всеми элементами, кроме инертных газов (аргон, криптон, ксенон, неон и гелий) и благородных металлов (золото, серебро, платина, палладий, родий и т.д.). Скорость реакции окисления резко возрастает при повышении температуры или применении катализаторов. Реакции окисления органических веществ в кислороде носят экзотермический характер и протекают с выделением большого количества теплоты.
- Кислород Из Кг Перевести В М3 Воздуха
- Кислород Из Кг Перевести В М3 Воды
- Кислород Из Кг Перевести В М3 Выраженную
Повышение давления и температуры кислорода в зоне реакции значительно ускоряет ее. В сжатом или нагретом кислороде процесс окисления при определенных условиях может протекать с нарастающей скоростью за счет повышения температуры в зоне реакции вследствие выделения теплоты. Технический кислород находит широкое применение во многих ведущих отраслях промышленности. Его используют для интенсификации выплавки стали (в мартеновских и электрических печах) и чугуна (в доменных печах), при кислородно-конверторной выплавке стали и получении цветных металлов из руд. Крупным потребителем кислорода является химическая промышленность. С его применением осуществляется газификация твердых топлив, конверсия газообразных углеводородов при получении синтетического аммиака, метанола и формальдегида, производство ацетилена из природного газа, азотной и серной кислот и другие процессы. Технический газообразный кислород применяют для газопламенной обработки металлов и других технических целей.

Медицинский газообразный кислород применяют для дыхания и лечебных целей. Согласно ГОСТ 5583-78 кислород различается различной степенью чистоты (99,7–99,2%). Следует учесть важное значение чистоты газа при сварке и резке металла. Снижение чистоты кислорода на 1% не только ухудшает качество сварного шва, но и требует увеличения расхода кислорода на 1,5%. Свойства Основные свойства кислорода приведены в таблице 1. Таблица 1 — Основные свойства кислорода Показатель Данные показателя Формула О 2 Молекулярная масса 31,9988 Плотность (при 0 °С и давлении 760 мм рт. Ст.), кг/м 3 1,43 Плотность (при 20 °С и давлении 760 мм рт.
Ст.), кг/м 3 1,33 Температура критическая, °С -118,8 Давление критическое, кгс/см 2 51,35 Температура кипения (при 760 мм рт. Ст.), °С -182,97 Температура плавления (затвердевания) (при 760 мм рт. Ст.), °С -218,4 Масса 1 л жидкости кислорода при -182,97 °С и 760 мм рт. Ст., кг 1,13 Количество газообразного кислорода, получающегося из 1 л жидкого, л 850 Массовая концентрация механических примесей в медицинском кислороде, предназначенном для авиации, – не более 0,001 г/м 3 с размером частиц не более 0,1 мм при 15 °С и 101, 3 кПа (760 мм рт. По физико-химическим показателям газообразный технический и медицинский кислород должен соответствовать нормам, указанным в таблице 2. Таблица 2 — Физико-химические показатели кислорода Наименование показателя Норма для марок Технический кислород Медицинский кислород Первый сорт Второй сорт Объемная доля кислорода,%, не менее 99,7 99,5 99,5 Объемная доля водяных паров,%, не более 0,007 0,009 0,009 Объемная доля водорода,%, не более 0,3 0,5 — Объемная доля двуокиси углерода,%, не более Не нормируется 0,01 Запах Не нормируется Отсутствие.
Примечания: 1. По согласованию с потребителем допускается в медицинском кислороде объемная доля кислорода не менее 99,2%. Медицинский кислород, предназначенный для авиации, должен выпускаться с объемной долей водяных паров не более 0,0007%. В техническом кислороде 2-го сорта, вырабатываемом на установках высокого, среднего и двух давлений, оснащенных щелочными декарбонизаторами для очистки воздуха от двуокиси углерода, а также на установках типа СКДС-70М допускается объемная доля кислорода не менее 99,2%.
Производство кислорода из воздуха В промышленности технически чистый кислород получают двумя способами:. из воздуха – методом глубоко охлаждения;. из воды – путем электролиза.

Расчет количества газа в баллоне. Перевод газовых величин. В сметах газ (кислород, пропан. Кислород, аргон, азот, гелий, сварочные смеси: 40-литровый баллон при 150 атм — 6 куб. М / гелий 1 кг, прочие сжатые газы 8-10 кг Ацетилен: 40-литровый баллон при 19 кгс/см2 — 4,5 куб. М / 5,5 кг растворенного газа Углекислота: 40-литровый баллон — 12 куб. М / 24 кг жидкого газа Пропан: 50-литровый баллон — 10 куб. М / 42 литра жидкого. Никопольский плацдарм карта. Ответ: В 50-литровом 'большом' пропановом баллоне 21 кг сжиженного газа или 10 кубометров газа в газообразном виде, но так прямо в лоб переводить в кубометры и считать по ним расход нельзя, потому что теплота сгорания сжиженного пропан-бутана в 3 раза выше, чем теплота сгорания натурального газа, а на котлах обычно пишут расход именно натурального газа!
Способ производства кислорода из воздуха более экономичный: на 1 м 3 кислорода расходуется 0,5–1,6 кВт/ч электроэнергии. Чтобы получить 1 м 3 кислорода путем электролиза воды требуется 10–21 кВт/ч. Атмосферный осушенный воздух представляет собой смесь, содержащую 20,93% кислорода и 78,03% азота, остальное – инертные газы, углекислый газ и пр.
Содержание водяных паров в воздухе может изменяться в зависимости от температуры и степени их насыщения. Для получения технически чистого кислорода воздух подвергают глубокому охлаждению и сжижают (температура кипения жидкого воздуха при нормальном атмосферном давлении –194,5 °С). Полученный жидкий воздух подвергают дробной перегонке или ректификации в ректификационных колоннах.
Возможность успешной ректификации основывается на довольно значительной разности (около 13 °С) температур кипения жидких азота (–196 °С) и кислорода (–183 °С). Воздух, засасываемый многоступенчатым компрессором, проходит сначала через воздушный фильтр, где очищается от пыли, затем проходит последовательно ступени компрессора.
За каждой ступенью компрессора давление воздуха возрастает и достигает 5–22 МПа в зависимости от системы установки и стадии производства. После каждой ступени воздух проходит водяной холодильник и влагоотделитель, где отделяется вода, конденсирующаяся при сжатии воздуха. Сжатый воздух из компрессора проходит через осушительную батарею из баллонов, заполненных кусками едкого натра, поглощающего влагу и остатки углекислоты. Затем сжатый воздух поступает в кислородный аппарат, где происходит охлаждение, сжижение и ректификация (разделением на кислород и азот). Газообразный азот применяют как защитный газ для сварки меди. Кислород направляется в газгольдер и подается для наполнения кислородных баллонов под давлением до 16,5 МПа; масса 1 м 3 кислорода при нормальном атмосферном давлении (0,1 МПа) и 0 °С составляет 1,43 кг, при 20 °С – 1,31 кг; масса 1 л жидкого кислорода равна 1,13 кг; в результате испарения образуется 0,79 м 3 газообразного кислорода (при 0 °С и нормальном атмосферном давлении); 1 кг жидкого кислорода занимает объем 0,885 л и, испаряясь, образует 0,70 м 3 газообразного кислорода (при 0 °С и атмосферном давлении 0,1 МПа).
Расчет объема газообразного кислорода в баллоне Объем газообразного кислорода в баллоне ( V) в кубических метрах при нормальных условиях вычисляют по формуле: V = K 1 V б, где V б — вместимость баллона, дм 3. В расчетах принимают среднюю статистическую величину вместимости баллонов не менее чем из 100 шт.; K 1 — коэффициент для определения объема кислорода в баллоне при нормальных условиях, вычисляемый по формуле: где P — давление газа в баллоне, измеренное манометром, кгс/см 2; 0,968 — коэффициент для пересчета технических атмосфер (кгс/см 2) в физические; t — температура газа в баллоне, °С; Z — коэффициент сжигаемости кислорода при температуре t.
Значения коэффициента K 1 приведены в таблице 3. ЛИТЕРАТУРА. ГОСТ 5583-78 Кислород газообразный технический и медицинский. Основы сварочного дела / В.Г. – М.: Высшая школа, 1991. Сварка, резка, пайка металлов – М.: Аделант, 2003. Сварочные работы своими руками – СПб.: Полиграфуслуги, 2006.
Газовая сварка / В.Г. – Мн.: Высшая школа, 2001. Газовая сварка и резка металлов / И.И. – М.: Высшая школа, 1986. Справочник молодого газосварщика и газорезчика / Д.З. – М., Высшая школа, 1974.
Сварочные работы / В.И. – М.: Академия, 2002. Сварка, резка и пайка металлов / К.К. М., Машиностроение, 1970, 408. Газопламенная обработка металлов / Г.В.
Полевой, Г.К. – М.: Академия, 2005.
Кислород химический элемент, атомный номер 8, атомная масса 15,9994. Обычно концентрация кислорода (в виде молекул O 2) в атмосфере на уровне моря составляет по объему 21%. Кислород немного тяжелее воздуха, вес 1 м 3 кислорода при 0° и 760 мм рт. Равен 1,43 кг. Плотность по отношению к воздуху 1,1.
Кислород Из Кг Перевести В М3 Воздуха
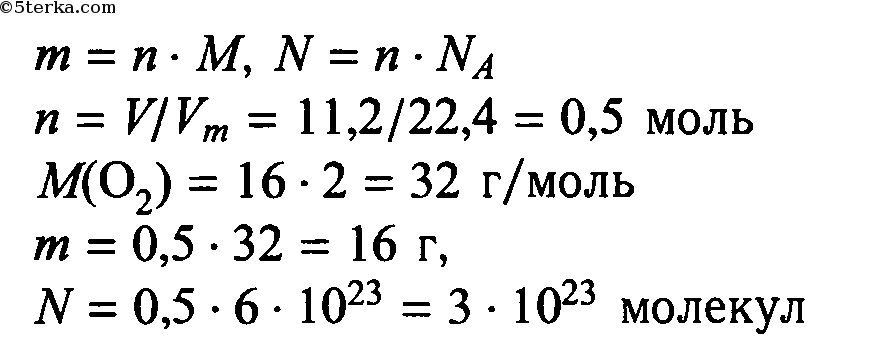
При температуре -182,97°C и давлении 760 мм рт. Кислород превращается в голубоватую легко подвижную жидкость, энергично испаряющуюся при нормальной температуре. При этом занимаемый газом объем уменьшается примерно в 850 раз. При нагревании жидкий кислород снова превращается в газ.
Вес 1 л жидкого кислорода при температуре -183°C равен 1,14 кг. Жидкий кислород при атмосферном давлении затвердевает при температуре -218,4°C и образует кристаллы голубоватого цвета. Химическая формула – O.
В обычных условиях молекула кислорода двухатомная - O 2. Кислород при нормальных условиях (температуре и давлении) представляет собой прозрачный газ без запаха, вкуса и цвета. Не относится к горючим газам, но способен активно поддерживать горение. По химической активности среди неметаллов кислород занимает второе место после фтора. Все элементы, кроме благородных металлов (платина, золото, серебро, родий, палладий и др.) и (, ксенон, криптон и неон), вступают в реакцию с кислородом (окисление) и образовывают оксиды. Процесс окисления элементов, как правило, носит экзотермический (с выделением теплоты) характер.
Также необходимо учитывать тот факт, что при повышении температуры, давления или использовании катализаторов – скорость реакции окисления резко возрастает. История открытия кислорода Открытие кислорода приписывают Джозефу Пристли (Joseph Priestley). У него была лаборатория, оборудованная приборами для собирания газов.
Пристли испытывал физиологическое действие кислорода на себе и на мышах. Он устанавливал, что после вдыхания кислорода некоторое время ощущается приятная легкость.
Мыши в герметически закрытой банке с воздухом задыхаются быстрей, чем в банке с кислородом. Поскольку Пристли был приверженцем флогистонной теории он так и не узнал, что оказалось у него в руках. Он только описал кислород, даже не догадываясь, что он описал.
Открыл кислород и дал ему имя Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier). Лавуазье, поставил свой знаменитый опыт, продолжавшийся 12 дней.
Он нагревал ртуть в реторте. При кипении образовывалась ее красная окись. Когда реторту охладили, оказалось, что воздуха в ней убыло почти на 1/6 его объема, а остаток ртути весил меньше, чем перед нагревом. Но когда разложили окись ртути сильным прокаливанием, все вернулось: и недостача ртути, и «исчезнувший» кислород.
Кислород Из Кг Перевести В М3 Воды
Впоследствии Лавуазье установил, что этот газ входит в состав азотной, серной, фосфорной кислот. Он ошибочно полагал, что кислород обязательно входит в состав кислот, и поэтому назвал его «оксигениум», что значит «рождающий кислоты». Теперь хорошо известны кислоты, лишенные кислорода (например: соляная, сероводородная, синильная и др.). Получение кислорода Кислород получают тремя способами:. разделение воздуха путем низкотемпературной ректификации (глубокого охлаждения);.
разложение воды путем электролиза (пропускание электрического тока);. химический способ.
Из атмосферного воздуха кислород получают методом глубокого охлаждения, как побочный продукт при получении азота. Данный способ мы рассмотрели в статье Производство кислорода путем пропускания электрического тока через воду (электролиз воды) с попутным получением водорода мы рассматривали в статье Химические способ получения малопроизводителен, а, следовательно, и неэкономичен, он не нашел широкого применения и используются в лабораторной практике. Кислород газообразный технический и медицинский выпускают. Хранят и транспортируют его в стальных баллонах под давлением 15 МПа.
Кислород Из Кг Перевести В М3 Выраженную
Кислородные окрашены в синий цвет с надписью черными буквами «КИСЛОРОД». Жидкий кислород выпускается. Кислород находится в жидком состоянии только при получении, хранении и транспортировке. Для газовой или газовой резки его необходимо снова превратить в газообразное состояние.
Коэффициент перевода объема и массы кислорода при Т=15°С и Р=0,1 МПа Масса, кг Объем Газ, м 3 Жидкость, л 1,337 1 1,172 1,141 0,853 1 1 0,748 0,876 Коэффициенты перевода объема и массы кислорода при Т=0°С и Р=0,1 МПа Масса, кг Объем Газ, м 3 Жидкость, л 1,429 1 1,252 1,141 0,799 1 1 0,700 0,876 Кислород в баллоне Объем баллона, л Масса газа в баллоне, кг Объем газа при Т=15°С, Р=0,1 МПа 40 8,42 6,3 Давление кислорода в баллоне при различной температуре окружающей среды Температура окружающей среды Давление в баллоне, МПа -40 10,4 -30 11,3 -20 12,1 -10 12,9 0 13,7 +10 14,5 +20 15,3.